Pengertian, Prinsip, dan Hukum Termodinamika – Kalau kita berbicara tentang termodinamika kita akan menemukan bahwa proses ini berkaitan dengan konversi energi dan pergerakan panas.
Apa itu konversi energi?
Konversi energi adalah perubahan bentuk energi
Contoh misalnya kenapa kita butuh makan? Supaya kita bisa mendapat energi yang cukup untuk beraktifitas dan bertahan hidup, tapi kamu tau ga? Sebenernya ketika kamu makan, yang dilakukan tubuh adalah mengubah energi yang terkandung dalam makanan jadi energi yang bisa kita pake dan akhirnya kita bisa beraktivitas. Nah inilah salah satu konversi energi yang terjadi di sekitar kita.
Energi dari makanan yang kita makan bisa kita konversi jadi energi gerak, energi gerak bisa kita konversi menjadi energi listrik dan listrik bisa kita konversi menjadi berbagai macam bentuk energi lain (panas, bunyi, gerak,dll).
Apa itu Termodinamika?
Termodinamika adalah salah satu cabang ilmu fisika yang fokus pada konversi energi.
Di dalam termodinamika kita belajar mengenai satu bentuk energi dalam bentuk kalor bisa dikonversi atau diubah menjadi bentuk energi lainnya. Termodinamika berhubungan erat dengan fisika energi, panas, kerja, entropi dan kespontanan proses.
Jadi dalam termodinamika, kalor ini merupakan bentuk energi yang akan dipindahkan melalui batas sistem pada temperatur tertentu, ke sistem lainnya (sekeliling) dengan temperatur yang lebih rendah.
Berarti disana ada proses pergerakan panas. Sebenarnya pergerakan panasnya dari mana ke mana? Apakah suhu rendah ke suhu tinggi atau sebaliknya? Nah hal ini diatur dalam Hukum ke-2 Termodinamika.
Panas dapat dikenali sesuatu itu panas, jika ia telah melewati batas sistem
Pengenalan Sistem dan Batas Sistem

Dalam termodinamika, objek yang diamatinya yaitu “Sistem” dan ada juga benda benda lain di luar objek disebut “Sekeliling”. Sistem bersama dengan sekelilingnya disebut dengan “Keseluruhan”
Sistem dipisahkan dari sekelilignya oleh suatu permukaan tertutup yang disebut “Batas sistem”. Batas sistem ini dapat mencegah terjadinya hubungan antara sistem dengan sekeliling.
Tahapan penting dalam analisis teknik adalah menjelaskan secara tepat apa yang sedang dikaji
Bagaimana kita dapat menjelaskan secara tepat objek yang sedang dikaji?
Pada Termodinamika digunakan terminologi sistem, untuk mengidentifikasi subjek analisis. Setelah sistem ini diidentifikasi dan interaksi yang berhubungan dengan sistem ini teridentifikasi maka 1 atau lebih hukum fisika dapat digunakan.
Daftar Isi :
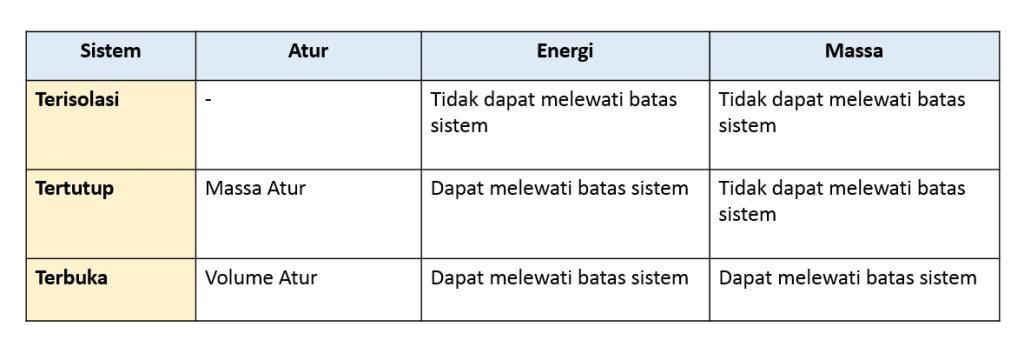
Ada tiga jenis sistem berdasarkan jenis pertukaran yang terjadi antara sistem dan lingkungan:
1. Sistem Terisolasi
Jika massa maupun energi tidak dapat melewati batas sistem maka ini disebut dengan sistem terisolasi
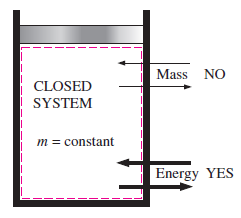
2. Sistem tertutup
Pada sistem tertutup, energi dapat melewati batas sistem tetapi massa tidak dapat melewati batas sistem. Pada sistem ini energi dapat melewati batas sistem dalam bentuk kerja atau panas.
Massa dalam sistem tertutup adalah konstan karena tidak ada massa yang masuk dan massa yang keluar dari sistem. Massa yang diamati dalam sistem tertutup disebut massa atur
3. Sistem terbuka
Pada sistem terbuka, massa dan energi dapat melewati batas sistem.
Energi dapat berpindah dalam 2 bentuk yaitu Usaha dan KalorKetika usaha dilakukan oleh suatu sistem maka sistem tersebut akan kehilangan kalor. Ketika usaha dilakukan terhadap sistem maka dia akan menerima kalor. Jadi dengan kata lain usaha akan berubah jadi kalor dan kalor berubah jadi usaha.
Nah perubahan ini tidak bisa terjadi secara acak. Di semesta ini ada hukum yang mengatur perubahan atau konversi energi tersebut. Hukum-hukum inilah yang kita kenal sebagai “Hukum Termodinamika”.
Ada 3 hukum termodinamika
Hukum Awal “Hukum ke Nol Termodinamika”
Pasti kalian bertanya Tanya, kenapa hukum pertama ga dinamakan hukum ke satu termodinamika? Jadi sebenarnya hukum ke Nol ini baru muncul setelah ada hukum ke satu dan hukum kedua termodinamika. Tapi karena hukumnya penting banget dan dasar makanya ilmuan ngasih nomor “Nol”.Pada hukum termodinamika ke Nol ini menjelaskan tentang suhu
Hukum ini menjelaskan mengenai kesetimbangan termal (memiliki suhu yang sama). Misalnya kalau kamu berada di kamar, maka seluruh benda yang ada di ruangan kamu akan memiliki suhu yang sama yaitu sebesar suhu ruangan. Suhu yang sama inilah yang dimaksud dengan kesetimbangan termal.
“Hukum ke Nol termodinamika” Jika 2 benda berada dalam kesetimbangan termal dengan benda ke 3, maka ketiga benda tersebut ada dalam kesetimbangan termal satu dengan yang lain
Jadi jika kalian perhatikan, dialam semesta semua benda tuh bakal berusaha masuk ke dalam kesetimbangan, nah caranya gimana? Yaitu dengan memindahkan energi dari satu benda ke benda lainnya.
Inilah kenapa ketika kita mengeluarkan es dari dalam kulkas maka es nya akan meleleh karena udara dan esnya sendiri berusaha mencapai kesetimbangan termal tadi.
Pertanyaannya panasnya bergerak dari mana ke mana?
Sesuai dengan pernyataan Clausius “Tidak mungkin suatu sistem apapun bekerja sedemikian rupa sehingga hasil satu-satunya adalah perpindahan energi sebagai panas dari sistem dengan temperatur tertentu ke sistem dengan temperatur yang lebih tinggi”
Jadi energi dari udara yang lebih panas bakal pindah ke es yang suhunya lebih dingin, sehingga suhu keduanya akan setimbang.
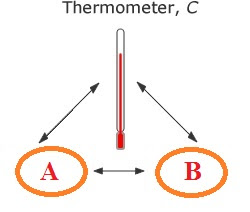
Suatu sistem disebut dalam kesetimbangan (equilibrium) jika sistem itu tidak condong untuk mengadakan perubahan dengan sendirinya
Nah kenapa energinya harus berpindah? Jadi di alam semesta ini yang namanya energi itu kekal, apa yang dimaksud dengan kekal?Energi itu tidak bisa diciptakan dan tidak bisa dimusnahkan, tapi bisa berubah dari satu bentuk ke bentuk lainnya
Inilah yang disebut sebagai hukum kekekalan energi.Di dalam termodinamika, hukum kekekalan energi ini menjadi dasar bagi hukum termodinamika.
Karena energi tidak bisa diciptakan atau dimusnahkan maka satu satunya cara suatu sistem dapat mendapatkan atau membuang energi yaitu dengan memindahkan dari benda lain atau dari lingkungan disekitarnya. Seperti yang tadi udah dijelasin diatas bahwa perpindahan energi akan berlangsung dalam 2 bentuk yaitu usaha dan kalor.
Walaupun wujudnya berbeda tetapi kedua proses ini saling berhubungan. Contohnya ketika kita melakukan suatu usaha saat kita berlari kita akan melepaskan kalor (panas) dan suhu tubuh kita menjadi naik. Karna suhu tubuh lebih tinggi dari suhu udara sekitar, maka kalor akan pindah dari tubuh kita ke udara.

Hukum Pertama Termodinamika
Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem. Hukum ini diturunkan dari hukum kekekalan energi yang mendefinisikan mengenai konversi energi.
“Bila energi diubah dari satu bentuk ke bentuk lainnya, banyaknya energi yang diubah itu adalah tetap”
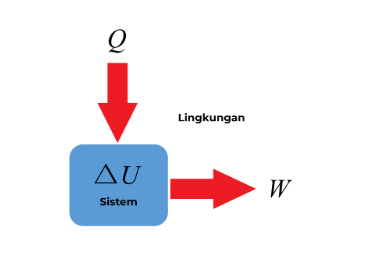
Dalam hukum pertama termodinamika ini bisa diterapkan dalam hubungan sistem – lingkungan seperti pada gambar berikut ini :
Energi kalor yang masuk dikurangi usaha yang keluar merupakan perubahan energi dalam sistem, yang dapat dituliskan dengan bentuk matematis :
ΔU= Q−W
Jadi perubahan energi dalam pada suatu sistem tertutup (ΔU) akan sama dengan kalor yang dipindahkan ke dalam sistem (Q) dikurangi usaha yang dilakukan oleh/pada sistem (W)
Catatan:
- Jadi kalau kalor pindah ke dalam sistem, maka sistemnya akan bertambah panas. Karena sistemnya bertambah panas maka Q nya bernilai (+)
- Jika Kalor berpindah keluar dari sistem maka sistemnya akan bertambah dingin jadi Q nya (-)
- Jika usaha dilakukan pada sistem maka W nya (-)
- Jika usaha dilakukan oleh sistem maka W nya (+)
Ketika suatu sistem berinteraksi dengan lingkungan sekitarnya sifat termodinamika dari sistem akan berubah sesuai dengan hukum 1 termodinamika. Perubahan ini bisa terjadi dalam proses termodinamika.
Hukum ini dapat diuraikan menjadi beberapa proses, yaitu proses dengan Isokhorik, Isotermik, Isobarik dan juga adiabatik.
Hukum Ke-2 Termodinamika
Dalam hukum termodinamika pertama membahas kembali mengenai hukum kekekalan energi dan konversi energi. Tapi pada hukum termodinamika pertama belum dijelaskan ke arah mana suatu perubahan keadaan itu akan berjalan. maksudnya gimana nih? loe mungkin bisa bayangi gini, waktu kita makan es tiba tiba mulut kita jadi terasa dingin.
Kenapa esnya bisa membuat mulut kita terasa dingin dan bukan sebaliknya?
Sebelumnya kita tahu pada hukum termodinamika Nol menyatakan bahwa benda-benda akan berusaha mencapai kesetimbangan termal, hal ini berarti es yang kita makan akan berusaha mencapai kesetimbangan termal dengan mulut kita. Terus lewat Hukum Pertama Termodinamika kita belajar mengenai kekekalan energi. Artinya apa? jadi pas minum es mulut kita tambah dingin karena energi berpindah dari mulut ke es sehingga suhu esnya jadi naik dan efeknya ya esnya meleleh. Nah tapi peristiwa itu tidak bisa terjadi sebaliknya, jadi tidak bisa energi dari es pindah ke mulut kita dan membuat mulut tambah panas. Nah proses ini dijelaskan dalam hukum ke-2 termodinamika.
Pada hukum pertama belum dijelaskan apakah perubahan keadaan itu bersifat reversible atau ireversible.
Pernyataan-pernyataan hukum Termodinamika ke-2:
1. Pernyataan Clausius mengenai hukum termodinamika ke-2:
Panas tidak akan mengalir dengan sendirinya dari benda yang dingin ke benda yang lebih panas.
2. Pernyataan Kelvin Planck mengenai hukum termodinamika ke-2:
Tidak mungkin suatu sistem yang bekerja dalam satu siklus untuk merubah panas dengan hanya satu reservoar dan menghasilkan sejumlah kerja yang positive dan ekuivalen.
Kenapa Aliran kalor harus dari suhu panas ke suhu dingin?
Ok pada dasarnya ini berkaitan dengan entropi. Apa itu Entropi?
Entropi adalah ukuran keacakan atau kekacauan suatu sistem
Semakin acak keadaan molekul suatu sistem semakin besar entropinya. Jadi uap air yang bergerak cepat dan acak memiliki entropi yang besar dibandingkan dengan es yg molekulnya rapat dengan sedikit pergerakan.
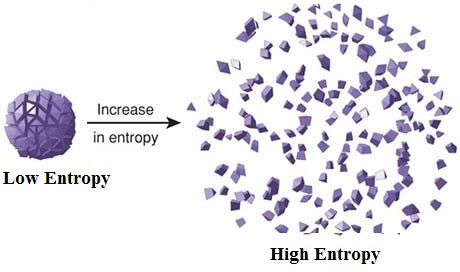
Konsep entropi ini berhubungan erat denga aliran panas tadi. Ketika suatu gas dipanaskan gas akan menerima kalor, hasilnya entropinya akan meningkat, karena gerakan molekulnya meningkat.
Ketika wujud benda berubah menjadi bentuk yang lebih teratur misalnya gas jadi cair, cair jadi padat. Entropi air akan menurun. Ketika entropi air menurun maka entropi dari lingkungan sekitarnya harus meningkat agar sistemnya dan alam semesta kita seimbang keseluruhan. maksudnya gimana nih?
Ketika air berubah menjadi es, kalor yang tadinya terperangkap dalam air harus ada yang nampung, inget kan dalam hukum termodinamika pertama menyebutkan bahwa energi itu gabisa dimusnahkan. Nah yang nampung itu adalah lingkungan sekitarnya dan karena harus nampung energi kalor tersebut entropi lingkungannya jadi naik. (belajarsesuatu.id)
Info ruanglab lainnya:
- Wow! Ternyata Urin Juga Bisa Digunakan Sebagai Sumber Energi
- Sosok Penemu Baterai Sumber Energi Listrik Praktis
- Ngeri! Bikin Stiker WhatsApp Pakai Wajah Orang Lain tanpa Izin Bisa Dipenjara